Energía interna
En física, la energía interna (U) de un sistema intenta ser un reflejo de la energía a escala macroscópica. Más concretamente, es la suma de:
- la energía cinética interna, es decir, de las sumas de las energías cinéticas de las individualidades que lo forman respecto al centro de masas del sistema,
- la energía potencial interna, que es la energía potencial asociada a las interacciones entre estas individualidades.
La energía interna no incluye la energía cinética traslacional o rotacional del sistema como un todo. Tampoco incluye la energía potencial que el cuerpo pueda tener por su localización en un campo gravitacional o electrostático externo.
Si pensamos en constituyentes atómicos o moleculares, será el resultado de la suma de la energía cinética de las moléculas o átomos que constituyen el sistema (de sus energías de traslación, rotación y vibración) y de la energía potencial intermolecular (debida a las fuerzas intermoleculares) e intramolecular de la energía de enlace.
- En un gas ideal monoatómico bastará con considerar la energía cinética de traslación de sus átomos.
- En un gas ideal poliatómico, deberemos considerar además la energía vibracional y rotacional de las mismas.
- En un líquido o sólido deberemos añadir la energía potencial que representa las interacciones moleculares.
Desde el punto de vista de la termodinámica, en un sistema cerrado (o sea, de paredes impermeables), la variación total de energía interna es igual a la suma de las cantidades de energía comunicadas al sistema en forma de calor y de trabajo 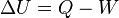 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo 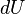 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.
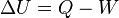 (En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo
(En termodinámica se considera el trabajo negativo cuando este entra en el sistema termodinámico, positivo cuando sale). Aunque el calor transmitido depende del proceso en cuestión, la variación de energía interna es independiente del proceso, sólo depende del estado inicial y final, por lo que se dice que es una función de estado. Del mismo modo 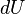 es una diferencial exacta, a diferencia de
es una diferencial exacta, a diferencia de  , que depende del proceso.
, que depende del proceso.El enfoque termodinámico: la ecuación fundamental
En termodinámica se deduce la existencia de una ecuación de la forma
conocida como ecuación fundamental en representación energética.
La importancia de la misma radica en que concentra en una sola ecuación toda la información termodinámica de un sistema. La obtención de resultados concretos a partir de la misma se convierte entonces en un proceso sistemático.
Si calculamos su diferencial:
se definen sus derivadas parciales:
- la temperatura

- la presión
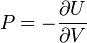
- el potencial químico
 .
.
Como T, P y
 son derivadas parciales de U, serán funciones de las mismas variables que U:
son derivadas parciales de U, serán funciones de las mismas variables que U:
Estas relaciones reciben el nombre de ecuaciones de estado. Por lo general no se dispone de la ecuación fundamental de un sistema. En ese caso sus sustitución por el conjunto de todas las ecuaciones de estado proporcionaría una información equivalente, aunque a menudo debamos conformarnos con un subconjunto de las mismas.



No hay comentarios:
Publicar un comentario